GASES
La
química se representa por medio de reacciones, ecuaciones, símbolos y
formas; una de esas formas son los gases, quienes se dividen en diferentes
leyes, por medio de las cuales se pueden hallar los diferentes partes de
la misma; en ellas conoceremos otros conceptos que veremos a continuación.
Objetivos:
-Entender
qué son los gases y las leyes que los componen.
-Ser
capaz de realizar cálculos a partir de las leyes de los gases.
-Brindar un patrón para explicar las
propiedades de los gases.
-Conocer las leyes de los gases, sus fórmulas y
formas de aplicación.
Procedimiento:
INTRODUCCIÓN
SALA DE BOYLE
SALA DE CHARLES
Marco teórico:
Definiciones:
GAS: Estado de agregación de la materia en el cual, bajo ciertas condiciones de
temperatura y presión, sus moléculas interaccionan débilmente entre sí, sin
formar enlaces moleculares, adoptando la forma y el volumen del recipiente que
las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por
su alta concentración de energía cinética. Los gases son fluidos altamente compresibles,
que experimentan grandes cambios de densidad con la presión y la temperatura.
ESTADOS DE AGREGACIÓN: Dependen fundamentalmente de las condiciones de
presión y temperatura a las que se someta la materia, además cuentan con tres
fases: sólido, líquido y gaseoso.
PRESIÓN: Es una magnitud física que
mide la proyección de la fuerza en dirección perpendicular por unidad de superficie,
y sirve para caracterizar cómo se aplica una determinada fuerza resultante
sobre una línea.
TEMPERATURA: Es una magnitud referida a las nociones comunes de calor medible mediante un termómetro.
VOLUMEN: Es el espacio ocupado por un cuerpo en un
lugar determinado y es determinado en tres dimensiones: largo, ancho y
largo.
MATERIA: Es todo lo que ocupa un espacio y posee
masa, forma, peso y volumen, por lo tanto es observable y medible.
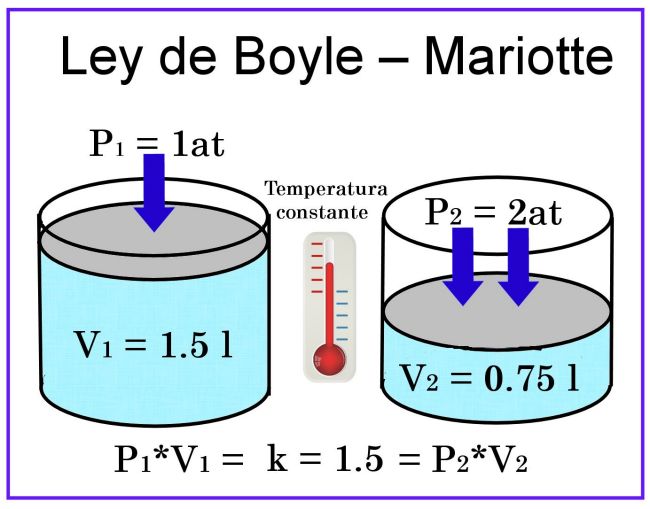
SALA DE BOYLE
A temperatura constante, el volumen de una muestra
de gas seco varía en forma inversamente proporcional a la presión a la que se
somete.
ECUACIÓN:
V1/V2 = P2/P1
SALA DE CHARLES
A presión constante, el volumen de un gas varía proporcionalmente a su
temperatura absoluta.
ECUACIÓN:
V1/T1 = V2/T2
Conclusiones:
Por medio de este blog se ha logrado reforzar los temas que componen los
gases como materia, volumen, presión, temperatura, estados de agregación y
gas.
También podemos decir que las leyes de Charles y Boyle son muy
importantes en la química ya que cada una tiene sus diferentes características.
La de Charles estudia la relación entre el volumen y la temperatura, con
presión constante. Por otro lado, la de Boyle establece que la presión de un
gas en un recipiente cerrado es inversamente proporcional al volumen del
recipiente, con la temperatura constante.
Webgrafía:
- https://es.wikipedia.org/wiki/Ley_de_Boyle-Mariotte
- https://es.wikipedia.org/wiki/Temperatura
- https://es.wikipedia.org/wiki/Presion
- https://es.wikipedia.org/wiki/Gas






NO SIGUIO EL DERROTERO ACORDADO FALTARON LOS EJERCICIOS 3.0
ResponderEliminar