EJERCICIOS, NEUTRALIZACION Y PH
DANIELA LEURO DUARTE
PRESENTADO ALA DOCENTE: DIANA FERNANDA JARAMILLO
CÁRDENAS
A LA ASIGNATURA DE: QUÍMICA
GRADO:10-03
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
IBAGUE-TOLIMA
2018
INTRODUCCIÓN
En este blog se mostraran diferentes ejercicios de la aplicación del ph y neutralizacion, y como es su funcionamiento
OBJETIVOS
- Profundizar el conocimiento de el PH y la neutralizacion
- Tipos de aplicación
- Beneficio y problemas
- Explicación de las propiedades del PH y la neutralizacion
MARCO TEÓRICO
La reacción entre un ácido y una base se denomina neutralización .
Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
Generalmente la siguiente reacción ocurre: ácido + base -> sal haloidea + agua
Neutralizacion: En el momento de la neutralización se cumple que el número de equivalentes de ácido que han reaccionado (N • V) es igual al número de equivalentes de la base (N' • V'): N • V = N' • V.'
Según el carácter del ácido y de la base reaccionante se distinguen cuatro casos: ácido fuerte + base fuerte ácido débil + base fuerte ácido fuerte + base débil ácido débil + base débil.
Se expresa como el logaritmo negativo de base de 10 en la actividad de iones de hidrógeno. Su fórmula se escribe de la siguiente manera:
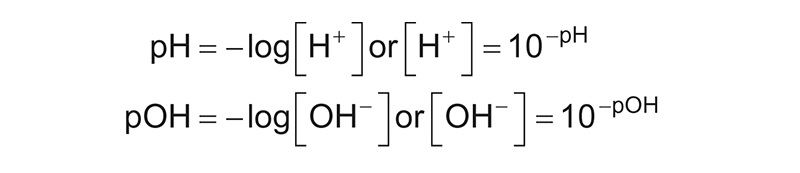
Cuando se obtiene mediante una medida de pH que un producto, sustancia o elemento es ácido, quiere decir que posee una alta o baja cantidad de iones de hidrógeno (dependiendo del nivel).
Por su parte, que la medición arroje que una sustancia es alcalina (base), significa que no cuenta con estas concentraciones de iones de hidrógeno. Por lo tanto el pH no es más que el indicador del potencial de hidrógenos.
Los ácidos y bases tienen distintas concentraciones de iones de hidrógeno, siendo los más fuertes, aquellos que contengan mayor cantidad de iones y los débiles lo que no posean tanta concentración, siendo el pH el encargado de expresar el valor numérico de las concentraciones de iones de hidrógeno, en algunos casos la carga de iones suele ser bastante baja, lo que se vuelve tedioso al momento de trabajar con dichas cifras, es por ello que se ideó una tabla única, llamada la “escala del pH”, la tabla se encuentra compuesta por 14 unidades numeradas, desde el 0 hasta el 14, siendo el 0 el punto máximo de acidez y el 14 la base máxima, el 7 representa el punto medio de la tabla y es neutro, lo que quiere decir que las soluciones con un valor por debajo del 7 son ácidas y las que están por encima son básicas.
La secuencia que tiene la escala del pH es logarítmica, lo que quiere decir que la diferencia entre una unidad numérica y otra, puede ser 10 veces más básica o ácida dependiendo del caso.
PROCEDIMIENTO:
- Procedimiento del ph
- Procedimiento titulación
Procedimiento PH:
- Se arrastra el indicador elegido se le agrega a cada uno de los tubos de ensayo en este aso es tornasol

- se repite el experimento con lo demás indicadores en este caso universal+h

El pH es la medida en la cual se determina el grado de acidez o alcalinidad de una sustancia, y que cuando una sustancia reduce su concentración también lo hará el pH de la sustancia. También que se debe usar diferentes sustancias indicadoras dependiendo de la naturaleza de la sustancia.

- se repite el experimento con lo demás indicadores en este caso universal+h

El pH es la medida en la cual se determina el grado de acidez o alcalinidad de una sustancia, y que cuando una sustancia reduce su concentración también lo hará el pH de la sustancia. También que se debe usar diferentes sustancias indicadoras dependiendo de la naturaleza de la sustancia.



Comentarios
Publicar un comentario