REACCIÓN QUÍMICA

La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos.
Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
ECUACIÓN QUÍMICA :
 Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas productos). La ecuación química ayuda a visualizar los reactivos que son los que tendrán una reacción química y los productos, que son las sustancias que se obtienen de este proceso. Además se pueden ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas productos). La ecuación química ayuda a visualizar los reactivos que son los que tendrán una reacción química y los productos, que son las sustancias que se obtienen de este proceso. Además se pueden ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.¿COMO ESCRIBIR UNA ECUACIÓN?
Se escribe en forma de ecuación sustituyendo el signo de igualdad (=) por una flecha (→) que indica el sentido de la misma.
Delante de cada fórmula se pone el número de unidades del elemento o del compuesto que intervienen en la reacción (excepto si ese número es 1) de manera que una vez completada, para cada elemento debe haber el mismo número de átomos en ambos términos. Por ejemplo, para indicar que cuando el carbono (C) se quema en presencia del oxígeno del aire (O2) se forma dióxido de carbono (CO2), se escribiría:
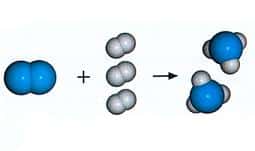
Si queremos escribir la reacción entre el hidrógeno (H2) y el oxígeno (O2) para formar agua (H2O), pondremos:
Y si queremos describir que la piedra caliza (carbonato de calcio: CaCO3) se descompone por el calor dando cal viva (óxido de calcio: CaO) y dióxido de carbono (CO2), tendríamos:
 Las reacciones de análisis o descomposición son lo opuesto de las reacciones de síntesis, o sea, un reactivo da origen a productos más simples que el. Escribiendo la reacción genérica nos resulta fácil entender lo que sucede:
Las reacciones de análisis o descomposición son lo opuesto de las reacciones de síntesis, o sea, un reactivo da origen a productos más simples que el. Escribiendo la reacción genérica nos resulta fácil entender lo que sucede:
 Las reacciones de desplazamiento o de sustitución simple merecen un poco más de atención que las anteriores. No que sean complejas, pues no lo son, pero tienen algunos pequeños detalles. En su forma genérica la reacción puede ser escrita como:
Las reacciones de desplazamiento o de sustitución simple merecen un poco más de atención que las anteriores. No que sean complejas, pues no lo son, pero tienen algunos pequeños detalles. En su forma genérica la reacción puede ser escrita como:
Delante de cada fórmula se pone el número de unidades del elemento o del compuesto que intervienen en la reacción (excepto si ese número es 1) de manera que una vez completada, para cada elemento debe haber el mismo número de átomos en ambos términos. Por ejemplo, para indicar que cuando el carbono (C) se quema en presencia del oxígeno del aire (O2) se forma dióxido de carbono (CO2), se escribiría:
- C + O2 → CO2
Si queremos escribir la reacción entre el hidrógeno (H2) y el oxígeno (O2) para formar agua (H2O), pondremos:
- 2 H2 + O2 → 2 H2O
Y si queremos describir que la piedra caliza (carbonato de calcio: CaCO3) se descompone por el calor dando cal viva (óxido de calcio: CaO) y dióxido de carbono (CO2), tendríamos:
- CaCO3 → CaO + CO2
CLASES DE ECUACIONES:
1- Reacciones de Síntesis o Adición

Las reacciones de síntesis o adición son aquellas donde las substancias se juntan formando una única sustancia. Representando genéricamente los reactivos como A y B, una reacción de síntesis puede ser escrita como:
A + B —– > AB
ejemplos
Fe + S —– > FeS
2H2 + O2 —– > 2H2O
H2O + CO2—– > H2CO3
2- Reacciones de Análisis o Descomposición
 Las reacciones de análisis o descomposición son lo opuesto de las reacciones de síntesis, o sea, un reactivo da origen a productos más simples que el. Escribiendo la reacción genérica nos resulta fácil entender lo que sucede:
Las reacciones de análisis o descomposición son lo opuesto de las reacciones de síntesis, o sea, un reactivo da origen a productos más simples que el. Escribiendo la reacción genérica nos resulta fácil entender lo que sucede:
AB —– > A + B
ejemplos:
2H2O 2 H2 + O2
2H2O2 2H2O + O2
3- Reacciones de Desplazamiento
 Las reacciones de desplazamiento o de sustitución simple merecen un poco más de atención que las anteriores. No que sean complejas, pues no lo son, pero tienen algunos pequeños detalles. En su forma genérica la reacción puede ser escrita como:
Las reacciones de desplazamiento o de sustitución simple merecen un poco más de atención que las anteriores. No que sean complejas, pues no lo son, pero tienen algunos pequeños detalles. En su forma genérica la reacción puede ser escrita como:
AB + C —– > A + CB
Vamos a entender lo que sucede: C cambio de lugar A. Simple asi, pero será que esto ocurre siempre? Intuitivamente la respuesta es que no. Imagina lo siguiente: Entras en un baile y ves a la persona con la que te gustaría bailar bailando con otra persona. Vas a ir hasta ella e intentar hacerla cambiar de pareja, estarás intentando desplazar el acompañante indeseable y asumir su lugar. Si resulta que eres más fuerte que el “indeseable” basta darle un empujón para asumir su lugar, pero si el fuera un bruto troglodita, posiblemente el no sentirá ni el empujón que le des.
En la reacción de desplazamiento el proceso es idéntico: C ve a B ligado a A, se aroxima y siendo más fuerte, desplaza A y asume la ligación con B. En caso que C no sea más fuerte que A, nada sucederá.
Bastará entonces saber quien es más fuerte que quien.
Au<Ag<Cu<H<Pb<Sn<Ni<Fe<Cr<Zn<Al<Mg<Na<Ca<K<Li
Metales nobles < hidrogeno < metales
De esta forma, tenemos:
2Na + 2H2O —– > 2NaOH + H2 (el sodio desplaza al hidrógeno del agua H-OH)
Au + HCl —– > no reacciona (el oro no consigue desplazar al hidrógeno)
4- Reacciones de Doble Sustitución
Son también muy simples, pero debemos quedar atentos a los detalles. El mecanismo es fácil:
AB + CD —– > AD + CB
Ciertamente ya habrá podido ver lo que sucede. A cambió de lugar con C. La diferencia de este tipo de reacción con el desplazamiento, es que ni A ni C estaban solos y en ambos casos ninguno de ellos quedó solo luego de la sustitución.
La substancia AB esta en solución y de esta forma lo que tenemos en verdad son los iones A+ y B- separados unos de los otros. La substancia CD también está en solución, por tanto tenemos también los iones C+ y D- separados.
Cuando juntamos las dos soluciones estamos promoviendo una gran mezcla entre los iones A+, B-, C+ y D-, formando una gran “sopa de iones”.
Si al combinar C+ con B-, el compuesto CB fuera soluble, los iones serán nuevamente separados en C+ y B-, resultando exactamente en la misma cosa que teníamos anteriormente. Lo mismo sucede con A+ y B-
Así, al mezclar AB con CD, estamos en verdad haciendo:
(A+ ) + (B- ) + (C+ ) + (D- )
Tomemos en cuenta que juntar iones que se separarán nuevamente resultará en la misma “sopa de iones” y no resulta en ninguna nueva susbtancia, por tanto no ocurre ninguna reacción.
Para que la reacción efectivamente ocurra, será necesario que al menos uno de los probables productos (AD o CB) no sean separados al juntarse, o sea, deben formar un compuesto insoluble y esto es logrado a través de una sal insoluble, de un gas o de agua.
Si uno de los productos fuera una sal insoluble el no será separado en iones y permanecerá sólido. Si fuese un gas, el se desprenderá de la solución (burbujas) y también permanecerá con sus moléculas agrupadas. Mientras que si uno de los productos fuese agua, ella no se desagrega en su propia presencia.
NaCl + AgNO3 —– > NaNO3 + AgCl
En esta reacción el producto AgCl (cloruro de prata) es insoluble, por tanto la reacción ocurre.
NaCl + LiNO3 —– > NaNO3 + LiCl
Como ninguno de los productos formados, NaNO3 (nitrato de sodio) o Lic. (Cloruro de Litio) es insoluble, la reacción no sucede.
NaOH + HCl —– > NaCl + H2O
Como uno de los productos es água (H2O), la reacción ocurre.
FALTO SEGUN INTERCAMBIO DE CALOR 4.0
ResponderEliminar